El enlace sigma (enlace σ) es el tipo más fuerte de enlace químico covalente. El enlace sigma se define más claramente para moléculas diatómicas usando el lenguaje y las herramientas de la simetría de grupos. En esta aproximación formal, un enlace σ es simétrico con respecto a la rotación alrededor del eje del enlace. Por esta definición, las formas comunes de enlace σ son s+s, pz+pz, s+pz, y dz2+dz2 (donde z está definido como el eje del enlace). La teoría cuántica también indica que los orbitales moleculares de simetría idéntica realmente se mezclan. Una consecuencia práctica de esta mezcla de moléculas diatómicas (equivalente a la hibridación de la Teoría del enlace de valencia), es que lasfunciones de onda de los orbitales moleculares s+s y pz+pz están mezclados. El alcance de esta mezcla de orbitales depende de las energías relativas de los orbitales moleculares de similar simetría.

Enlaces pi
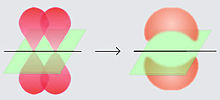
Los enlaces pi (enlaces π) son enlaces químicos covalentesdonde dos lóbulos de un orbital electrónico se trasladan pero lo obstruyen con dos lóbulos del otro orbital electrónico involucrado. Sólo uno de losplanos nodales de los orbitales pasa a través de los núcleos involucrados.
La letra griega π en su nombre se refiere a los orbitales p, dado que la simetría de los orbitales de los enlaces pi es la misma de la de los orbitales p. Generalmente, los orbitales p están involucrados en este tipo de enlace. Se asume que losorbitales d también participan en el enlace pi, pero esto no es necesariamente el caso en la realidad, aunque el concepto de enlace por medio de orbitales d explica bien la hipervalencia.
No hay comentarios:
Publicar un comentario